打造可靠干细胞,见证品牌实力
原创 转网 转化医学网

本文为转化医学网原创,转载请注明出处
作者:Jevin
导读:造血干细胞移植可用于治疗某些癌症和遗传性疾病。造血干细胞分化成血系,并在受体的一生中自我更新。多能干细胞品系可以解决目前HLA匹配供体的短缺问题,并提供丰富的转基因干细胞来源用于治疗遗传性血液疾病,包括免疫缺陷和代谢紊乱。研究人员开发了一种微流体培养系统来模仿原始胚胎循环,并解决了循环流动和剪切应力增强胚胎血液发育的假设。胚胎造血来自人多能干细胞,并通过小分子操作TGF-β和WNT信号传导从中胚层诱导。
近日,澳大利亚新南威尔士大学和墨尔本大学的研究团队在《Cell Reports》上发表了研究成果。研究表明在实验室中使用微流体设备模拟胚胎心脏跳动,可诱导人类造血干细胞前体的发育,这些前体可进一步发育成造血干细胞。

造血干细胞
01
造血干细胞是可以分化出所有血细胞的干细胞。人类的造血干细胞在胚龄第2~3周时开始产生,主要产生位置在卵黄囊。胚龄第2~3月时,主要产生造血干细胞的位置在肝和脾。胚龄第5个月起,一直到出生之后,主要产生造血干细胞的位置则在骨髓。
造血干细胞分化出的血细胞可以分成两大群系:骨髓群系和淋巴群系,两者皆参与树突状细胞的形成。骨髓群系的细胞包含有:单核球、巨噬细胞、嗜中性白血细胞、嗜碱性白血细胞、嗜酸性白血细胞、红血细胞、巨核细胞和血小板。淋巴群系的细胞则有:T细胞、B细胞、自然杀手细胞等。造血干细胞的移植可用来治疗癌症和其他免疫性疾病。
造血干细胞移植可用于治疗某些癌症和遗传性疾病。造血干细胞分化成血系,并在受体的一生中自我更新。多能干细胞品系可以解决目前HLA匹配供体的短缺问题,并提供丰富的转基因干细胞来源用于治疗遗传性血液疾病,包括免疫缺陷和代谢紊乱。
微流体培养系统
02
科学家很久前就开始研究诱导性多能干细胞,但如何在实验室中人工安全地模拟人体内的细胞分化,以提供有针对性的医学治疗仍然是一个挑战。尝试在实验室中制造造血干细胞,可解决供体造血干细胞短缺的问题。但目前这一设想尚未被实现。
了解胚胎发育微环境中发生的所有过程对于制造造血干细胞有很大意义,心血管系统和主动脉的发育与最终造血功能的发育密不可分。在胚胎发育过程中,血细胞通过内皮-造血转换过程从造血内皮细胞衍生而来,EHT最初发生在卵黄囊中,然后发生在胚胎中。在胚胎中,成体HSC的前体首先出现在主动脉-性腺-中肾区域,形成主动脉内造血簇。从人类胚胎干细胞分化出HOXA+造血脉管系统是AGM衍生的造血干细胞谱系发育所必需的。脉动性主动脉血流产生主动脉壁剪切应力和周向拉伸被假设为驱动EHT的机械因素,但是其对HOXA+造血生态位和AGM衍生的造血干细胞谱系发育的影响尚未可知。
为此,研究人员开发了一种微流体培养系统来模仿原始胚胎循环,并解决了循环流动和剪切应力增强胚胎血液发育的假设。胚胎造血来自人多能干细胞,并通过小分子操作TGF-β和WNT信号传导从中胚层诱导。
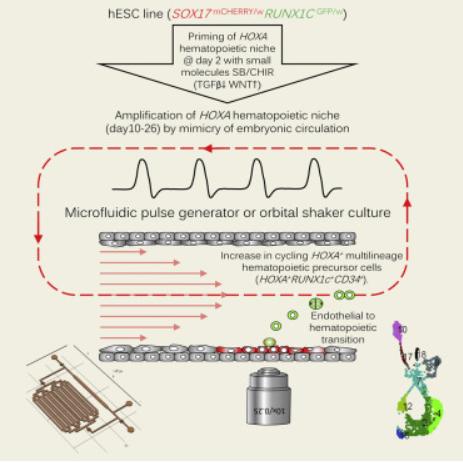
微流体培养系统模拟诱导造血干细胞前体发育
03
EHT在人胚胎主动脉中的直接可视化是不可能的,因此目前的知识依赖于微解剖的人胚胎主动脉的单细胞转录组学和hESC衍生造血。
因此,研究人员利用微流体脉冲发生器,以模拟和观察胚胎循环对hESC衍生血液形成。MPG驱动具有2-3μL循环体积的微流体回路周围的流动。在贴壁细胞层上再循环的条件培养基充分混合并每天更换。

微流体培养系统模拟诱导造血干细胞前体发育
03
EHT在人胚胎主动脉中的直接可视化是不可能的,因此目前的知识依赖于微解剖的人胚胎主动脉的单细胞转录组学和hESC衍生造血。
因此,研究人员利用微流体脉冲发生器,以模拟和观察胚胎循环对hESC衍生血液形成。MPG驱动具有2-3μL循环体积的微流体回路周围的流动。在贴壁细胞层上再循环的条件培养基充分混合并每天更换。
结果表明RUNX1C-GFP+在EHT后上调。免疫表型分析显示更多数量的RUNX1C-GFP+、SOX17-mCHERRY+和CD34+细胞,以及红细胞、骨髓、巨核细胞和祖细胞。
轨道振荡器培养产生循环 HOXA 多系造血前体细胞
轨道振荡器培养为研究循环流动的影响提供了另一种模型。平衡实验设计和因子分析用于量化循环流和SB / CHIR培养对SOX17-mCHERRY血管形成,造血前体形成和单细胞基因转录和固定培养分别作为SB / CHIR处理和轨道振荡器培养的对照。
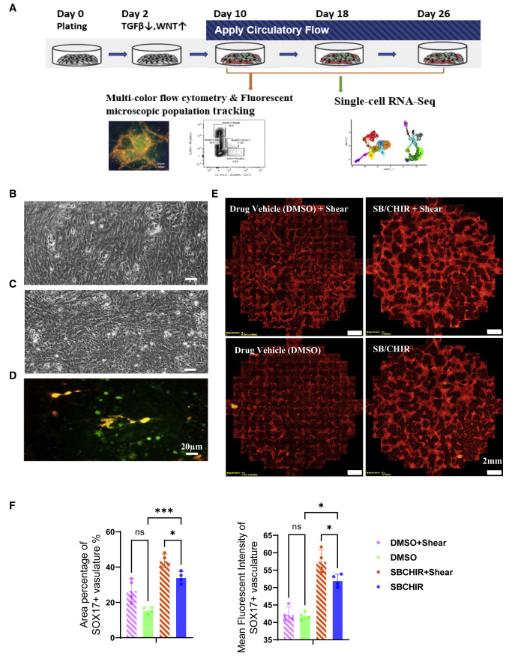
轨道振动系统培养使NOTCH基因表达增加50倍以上,其水平与SB/CHIR固定培养的水平相似。此外,SB/CHIR处理导致CD34+细胞、CD7+造血前体细胞、白细胞、巨核细胞和多能祖细胞、骨髓和红细胞的多系潜能增加,带有轨道振动系统的SB/CHIR增加了来自纯化的CD34+细胞以及集落形成细胞的巨核细胞和红细胞的产量。
单细胞转录分析揭示了HOXA产血生态位的分子特性
采用scRNA-seq和均匀流形近似投影聚类分析。在分化培养的第18天对8,800个细胞进行scRNA-seq。对汇总数据的分层聚类分析确定了19个细胞亚群。该算法将非造血和造血聚类分别分组到UMAP图的左侧和右侧。非造血细胞分泌细胞外基质蛋白,如胶原3A1和纤连蛋白。
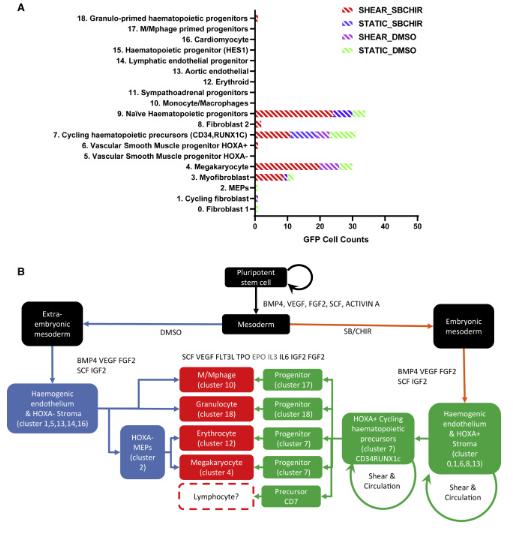
在CS10-11胚胎和卵黄囊 HPC 中。在分化第9天添加到培养基中的造血生长因子很可能揭示了各种造血前体群体可能采取的谱系分化途径,产生分化为红系和巨核细胞谱系的MEP。随着HOXA主动脉内皮和基质的发育,以及循环的RUNX1C-GFPCD34前体的产生,在SB / CHIR中添加旋转培养物增强了HOXA胚胎龛,从而产生了骨髓,巨噬细胞/单核细胞和CD7前体。
研究揭示了如何通过人工诱导的方式来获得这些造血干细胞前体,这一研究成果意味着人类向使用诱导多能干细胞治疗遗传性血液疾病等又进了一步,未来或许可以解决造血干细胞供体短缺问题。
免责声明:本文仅供参考并不构成任何应用建议,如文章内容涉及版权或其他问题,请及时跟本站联系,我们将在第一时间处理。我们多次学习最新广告法,
守法是我们的责任义务,科学普及知识,我们尊重原创,也注重分享,部分图文素材来源于网络,如有违规或侵权,请及时联系我们会及时删除。
Copyright©2004-2024. http://www.gjsysw.com All rights reserved. 版权所有:上医生物 浙ICP备2024126152号-1

1、任何有关干细胞问题,都可以扫描二维码直接与我们在线医护沟通交流;